
医薬品受託製造(CMO)
御社でも国内医薬品製造において厳しい競争下に置かれてはないでしょうか?
御社の社員、製品は素晴らしいはずなのに国内の病院、薬局では御社の製品の認知がされてないのではないでしょうか。
当社に医薬品受託製造(CMO)を依頼するメリット

<メリット>
- 国内で勝ち続ける多くのマーケットの発掘
- 御社の組織力を安定的に強化
- 御社の国内認可済みの医薬品が海外でも許認可が可能。
国内のメーカーが全てゼロからの開発は必要ではなく、御社が国内で既に認可を得ている商品でも、様々な国で認可を取ることが可能です。
当社と共に海外での医薬品販売にご興味がありましたら、
詳しくは弊社までお問い合わせください。
当社は日本の製薬会社の医薬品はとても優秀だと確信しております。
なぜならば、日本人は優れたモノづくりに長けているからです。当社は販売を専門に行っており、もちろん国内だけでなく海外のネットワークも充実しております。
御社は自信のあるモノづくりをされており、製品も優れているでしょう。
是非、当社と共に海外市場へ進出しませんか。
日本の医薬品でも海外市場で簡単に認可が取れますか?
日本もPIC/Sの加盟国です。
これは、全ての医薬品は製造から管理、販売までPIC/S基準を守らないといけません。
各国の医薬品認可の手続きが多少異なるかもしれませんが、全てのプロセスはPIC/Sへ提出し進めれば問題はございません。
*注釈PIC/S:Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme(訳:医薬品査察協定及び医薬品査察共同スキーム)

当社では、近年の製薬会社のビジネスモデルの変化する中で、GMPに則った薬品受託製造(研究、開発、製造、販売までの全ての工程)を支援させて頂きます。
<受託製造の流れ>
STEP5 ⇒ 技術及び製造方法、試験方法の検討。
(技術移管や必要設備等について併せて検討)
STEP6 ⇒ 医薬品製造販売,該当国医薬品販売認可に必要な申請
医薬品受託製造(CMO)メリット
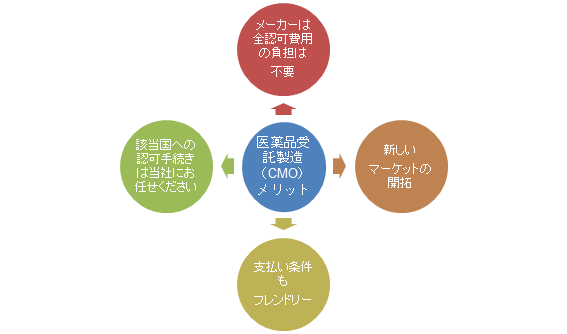
製薬会社様は、認可取得まで時間が掛かるかもしれませんが、その間に当社は海外の輸入者と注文量を決める等、認可取得後もスムーズにお取引が出来るように準備を進めさせていただきます。
全ての現地で発生する認可の手続き費用は弊社もしくは現地、輸入者が負担する形となります。
事前に当社と該当輸入者間で注文量を契約し、認可を得たましたら、御社(製薬会社様)に注文をさせて頂きます。
注文後に速やかに御社に送金を致します。
当初は様々な課題が発生するかもしれません。
ですが、全て順調に進みましたら御社にとっては「コロンブス」が新大陸を発見したかのように新しいマーケットに出会えることでしょう。
御社にとっての強力な新しいマーケットの参入が始まります。
STEP1 ⇒ 受託製造に関してマーケットの売上予測

皆さんは海外のマーケットを知らずに参入するのは不安ではないでしょうか?
例えば、あの国の薬機法の基準はどうなっているのか?または、海外の認可手続きは難しそう。当社は、その気持ちが良く分かります。
当社は全ての取引において医薬品製造会社様へ受託製造を依頼する前に、マーケット規模を調査し売り上げ予測を立ててからメーカーへ提出致します。このようにしないと、当社にとってもリスクとなってしまい、市場からの信頼も失ってしまう恐れがあるからです。
信用、信頼関係を築きながら是非、御社と末永い関係を構築していきたいです。
その際にぜひ当社と長い商売を進めて頂きたいです。
STEP2 ⇒ 貿易条件を検討「例えば、支払い条件」

御社との次のステップは、秘密保持契約を締結する前に全ての貿易条件について契約を結ぶ必要があります。納期に対していつまでに注文をしなければならないのか、どのような形式で注文をするのか等、お互いに最適な条件の調整が必要になります。
そして最後は、メーカーにとって一番重要な、支払い条件の確認です。
STEP3 ⇒ 受託製造の内容の確認(秘密保持契約の締結)

御社と共に計画から取引開始までに受託製造の内容の確認(秘密保持契約の締結)が必要です。
当社のお客様、又は現地国のマーケット情報、関連する利益、不利益な情報等についての機密保守義務を守らなければなりません。
これは当社側ではなく、御社がどのような医薬成分、設備、技術を利用するのか等の秘密情報を知らない第三者へ開示、漏洩しないことを契約により遵守させるものになります。
このように厳格な手続きを踏むことが、御社にとって最大の利益になるはずです。
STEP4 ⇒ 受託内容を検討しお見積りを提出

さて、いよいよ御社からお見積りを頂きます。
秘密保持契約の締結も終えて、全ての役割(御社-当社-当社のお客様)も明確となり自らの売上、利益も明確に予測が出来る状況です。
STEP5 ⇒ 技術及び製造方法、試験方法の検討。(技術移管や必要設備等について併せて検討)

現地国での製造基準は多少異なるかもしれませんが、全てはPICS/S : Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme(日本語で医薬品査察協定及び医薬品査察共同スキームという組織)のガイドラインに則って生産が必要になります。全て現地国の基準を遵守しながら御社に最適な技術、製造方法、及び試験方法について計画を立ててから、、、、、
、、、、次のステップへ進みます。
国内のメーカーが全てゼロからの開発は必要ではなく、御社が国内で既に認可を得ている商品でも、様々な国で認可を取ることが可能です。
当社と共に海外での医薬品販売にご興味がありましたら、詳しくは弊社までお問い合わせください。
STEP6 ⇒ 医薬品製造販売、該当国医薬品販売認可に必要な申請

国ごとに認可に必要な期間は異なります。
当社はアメリカから様々な国で申請の経験があり、どのような質問があり、どのように回答をすれば良いのかノウハウを持っておりますが、順調に手続きが進んだとしても多少のお時間はかかると考えてください。
例えば、なぜ御社がそのような成分を使用するのかの質問に対し、当社は現地国へ赴き説明をする必要があります。申請に関し現地担当者の理解によって受理される場合も、拒否される場合もあります。
もし拒否された場合でも、弊社には解決策がありますのでご安心下さい。
日本国内の製薬会社の海外におけるジェネリック、新薬の認可取得数はアメリカや西ヨーロッパより少ないかもしれません。
ですが、海外進出し成功している国内製薬会社も多数あります。
当社は国内製薬会社様と共に成功すべく全力を尽くしていきます。
知識、経験が豊富な当社へ認可申請をお任せください。
STEP7 ⇒ 認可受理・合格

認可申請が受理し合格した場合、マーケットを独占できる場合があります。
以前、当社の香港本社でシンガポールからの外来プロジェクトがあり、アメリカ米FDAへマスク認可申請をしました。2年以上の期間が掛かりましたが、そのマスクの申請は受理されました。
そして、そのお客様は当社の全スタッフをシンガポール旅行の招待をし、その夜、シンガポールの社長は沢山のシャンパンを開け、お祝いをしました。
このような事例は稀ではありますが、当時、アメリカでその医療用マスクの販売をしているのは、当社のお客様とスリー社の2社しかない状態でした。
そのため、そのシンガポールのお客様は医療用マスク販売のみで多大の利益を得る事が出来ました。
STEP8 ⇒ 当社から注文

認可が下りた後は、次は、当社から注文を致します。全ての注文は納期を決定してから、御社へ支払い保証がある形で進めます。
STEP9 ⇒ 受託生産開始(申請等完了後)

全ての契約が完了後、御社もスケジュール通りに生産を行ってください。
もし、原料の事情や不測の事態により生産スケジュールへ影響がある場合は、当社へ速やかにご連絡ください。
STEP10 ⇒ 現地国へ商品を出荷

御社が全商品の生産完了後、速やかに現地国へ商品発送をして下さい。
商品は現地国へ到着後に、当社は現地国の各病院、各薬局への配送調整が必要になります。
国内のメーカーが全てゼロからの開発は必要ではなく、御社が国内で既に認可を得ている商品でも、様々な国で認可を取ることが可能です。
当社と共に海外での医薬品販売にご興味がありましたら、詳しくは弊社までお問い合わせください。
メールにてお問い合わせ、お願い致します。 営業時間 9:00 – 18:00 [ 土日・祝日除く ]
お問い合わせはこちら お気軽にお問い合わせください。